РМ359
Компания Prime Medicine выпустила пресс-релиз о том, что впервые в клинической практике применила технологию прайм-редактирования (Prime Editing) для лечения человека с хронической гранулематозной болезнью (ХГБ).
Хроническая гранулематозная болезнь – редкое наследственное заболевание, вызываемое мутациями в субъединицах комплекса НАДФН-оксидазы. ХГБ проявляется тяжёлыми инфекциями и аутоиммунными осложнениями с раннего возраста. Без диагностики и лечения заболевание часто приводит к летальному исходу.
Учёные из Prime Medicine разработали терапию для исправления мутации. Пациенту была введена однократная доза PM359 – аутологичных гемопоэтических стволовых клеток, отредактированных с помощью технологии Prime Editing. Уже на 15-й день после лечения активность НАДФН-оксидазы восстановилась у 58% нейтрофилов, а на 30-й день – у 66%. Это значительно превышает порог в 20%, который считается минимально необходимым для клинической пользы.
Также у пациента наблюдалось быстрое приживление стволовых клеток: в нейтрофилах – на 14-й день, в тромбоцитах – на 19-й. Для сравнения: при других генных терапиях эти сроки могут достигать 27 и 35 дней соответственно. Побочные эффекты соответствовали ожидаемым для предшествующего химиотерапевтического воздействия, а серьёзных нежелательных явлений, связанных с PM359, зафиксировано не было.
Это первое в истории подтверждение того, что технология Prime Editing может не только безопасно использоваться в лечении, но и демонстрировать клинически значимый эффект. Однако специалисты подчёркивают: данные получены лишь от одного пациента и являются предварительными. Для окончательных выводов потребуется время, дополнительные исследования и наблюдения за долгосрочным эффектом терапии. Кроме того, результаты пока не опубликованы ни в одном из рецензируемых научных журналов.
Редактирование ДНК нового поколения
Прайм-редактирование (Prime Editing) – это метод сверхточного редактирования ДНК, разработанный в 2019 году группой учёных под руководством Дэвида Лю в Broad Institute (MIT и Гарвард). Этот метод ещё прозвали «генетическим текстовым редактором». В отличие от классического CRISPR-Cas9, который делает разрывы в ДНК и полагается на естественные механизмы репарации, Prime Editing позволяет точечно изменять генетическую последовательность без двуцепочечных разрывов. Другими словами, аккуратно заменяет нужные «буквы» в генетическом коде, что снижает риск нежелательных мутаций.
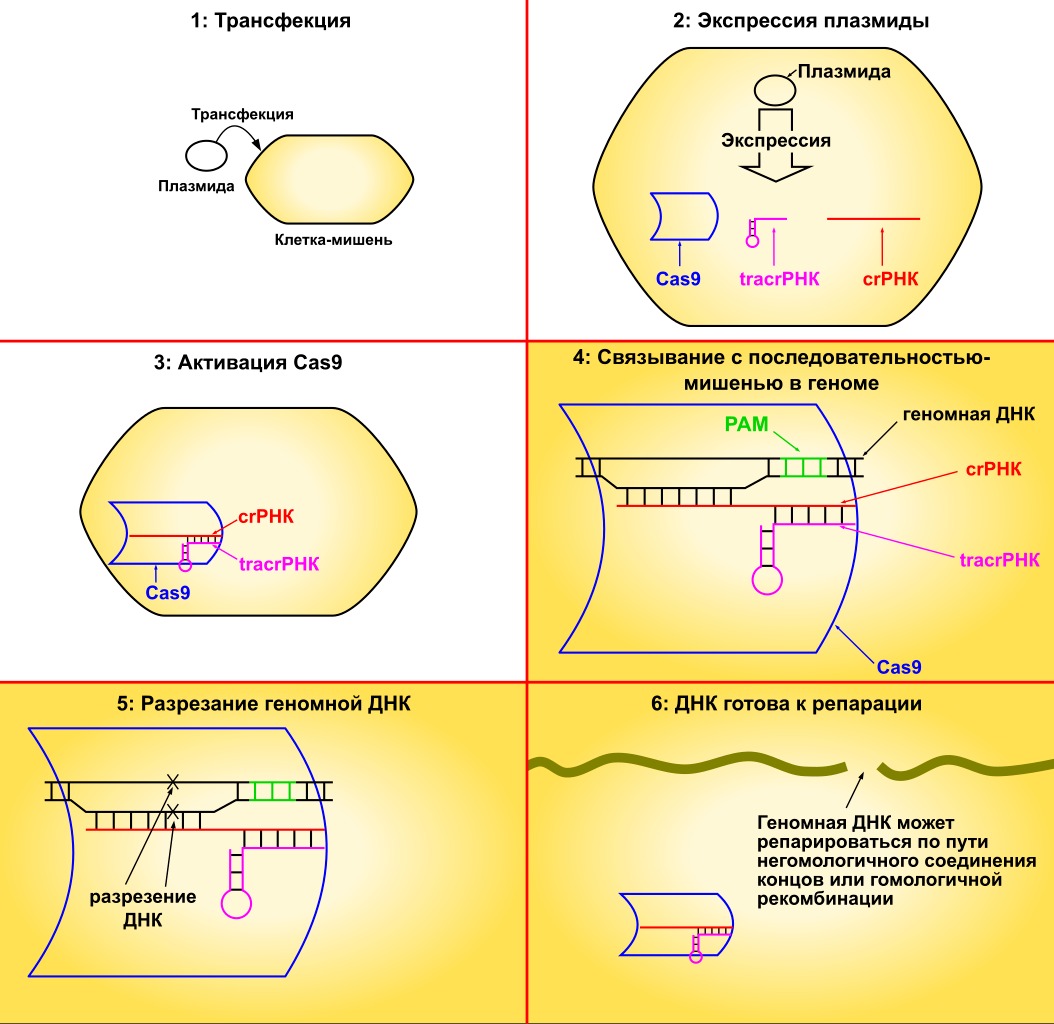 Принцип использования CRISPR-Cas для редактирования генома. Фото: Nielsrca, Kaidor
Принцип использования CRISPR-Cas для редактирования генома. Фото: Nielsrca, KaidorПрайм-редактирование на сегодняшний день – одна из самых многообещающих технологий генного редактирования. До сих пор её применяли только в лабораториях и на животных моделях, и никто не знал, как она будет работать у людей. Теперь впервые есть реальные клинические данные – пусть и предварительные – об успешном применении у человека
«Эти данные – важная веха не только для пациентов с ХГБ, но и для всей области генной медицины. Они подтверждают, что Prime Editing может корректировать патогенные мутации и потенциально изменить течение тяжёлых генетических заболеваний», – отметил Дэвид Лю, соучредитель Prime Medicine и один из создателей технологии Prime Editing.
Что дальше
Несмотря на многообещающие результаты, Prime Medicine не планирует дальнейшую клиническую разработку PM359. В настоящий момент компания ищет партнёров для дальнейшего продвижения терапии ХГБ. Это решение связано с высокой стоимостью разработок методов генной инженерии для лечения очень редких заболеваний.
«Наука продвинулась достаточно далеко, чтобы методы генной инженерии приносили пользу многим пациентам. Но это сводится к вопросу не только науки и технологий – но и экономики», – комментирует Дэвид Лю.
Так, стоимость единственно одобренной сегодня CRISPR-терапии (на основе CRISPR-Cas9) для лечения заболеваний крови – серповидноклеточной анемии и β-талассемии – превышает 2 млн долларов за дозу. Это фактически делает терапию недоступной для большинства пациентов. Поэтому сейчас CRISPR-терапия остаётся элитарным методом, несмотря на то что потенциально может помочь тысячам пациентов по всему миру, страдающим от тяжёлых генетических заболеваний.
 Схема конструирования плазмиды CRISPR Cas9. Фото: Nielsrca, Kaidor
Схема конструирования плазмиды CRISPR Cas9. Фото: Nielsrca, KaidorГенная терапия: от надежды к скандалам
Ещё несколько десятилетий назад идея исправлять генетические дефекты прямо в ДНК казалась научной фантастикой. Сегодня генная терапия – это реальность, меняющая подход к лечению тяжёлых заболеваний. Но путь к этой революции не обошёлся без громких скандалов и этических дебатов.
Впервые концепцию генной терапии предложили учёные Теодор Фридманн и Ричард Роблин в 1972 году, изложив её в статье в Science. Они предположили, что исправление мутаций может стать лечением наследственных болезней.
Первый случай применения генной терапии произошел в 1990 году в США. Пациенткой стала 4-летняя девочка с тяжёлым иммунодефицитом. Ей ввели исправленный ген, и она начала выздоравливать. Это стало прорывом. Однако вскоре стало ясно, что метод не так прост и безопасен.
В 1999 году 18-летний Джесси Гелсингер умер во время испытаний лечения от генетического дефекта, связанного с тяжелым нарушением обмена веществ. Причиной стала гиперреакция иммунитета на вмешательство в работу клеток. Этот случай заставил FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) приостановить сотни исследований и пересмотреть правила безопасности. FDA играет ключевую роль в допуске новых медицинских технологий и лекарств к применению в США.
Следующий прорыв произошел в 2012 году, когда Дженнифер Дудна и Эммануэль Шарпантье открыли систему CRISPR-Cas9, позволившую редактировать гены с невиданной точностью.
 Эммануэль Шарпантье и Дженнифер Дудна. Фото: Bernhard Ludewig и Brittany Hosea-Small / Nobel Prize Outreach
Эммануэль Шарпантье и Дженнифер Дудна. Фото: Bernhard Ludewig и Brittany Hosea-Small / Nobel Prize OutreachCRISPR обещал излечение наследственных болезней, а также улучшение здоровья миллионов. Но с его приходом возникли и новые вызовы – в первую очередь этические. В 2018 году мир потряс скандал: китайский учёный Хэ Цзянькуй заявил, что изменил гены эмбрионов, чтобы сделать девочек Лулу и Нану устойчивыми к ВИЧ. Это вызвало волну осуждения со стороны научного сообщества. Редактирование проводилось втайне, без научного рецензирования и с явными нарушениями этических норм. В 2019 году Хэ Цзянькуй был приговорён к 3 годам тюрьмы. Сейчас он вышел на свободу и продолжил работу в Китае.
Другой трагический случай из-за генной терапии – на этот раз CRISPR-терапии – случился в 2022 году. Умер 27-летний пациент с мышечной дистрофией Дюшенна. Расследование показало, что причиной стала не сама технология CRISPR, а смертельный иммунный ответ на вирусный вектор (AAV9), использованный для доставки модифицированного белка CRISPR-dCas9-VP64.
В 2015 году журнал Nature Nanotechnology отозвал статью, в которой описывался новый метод секвенирования ДНК с использованием измерений электрической проводимости ДНК-полимеразы. Авторы утверждали, что обнаружили способ электрического связывания молекул ДНК и ферментов, который позволяет «сшивать» или стабилизировать их контакт для последующего анализа. Журналисты в своих материалах нарекли новый метод «био-клеем» для ДНК. Однако исследовательское сообщество выразило серьёзные сомнения в достоверности представленных данных. Журнал инициировал расследование, в ходе которого выяснилось, что авторы не смогли воспроизвести результаты своих экспериментов и не предоставили полный набор исходных данных, необходимых для подтверждения выводов. В результате статья была официально отозвана. Этот случай показал, что даже ведущие научные журналы не застрахованы от публикации недостоверных данных.
Немыслимое стало возможным
Генная терапия сегодня успешно применяется для лечения различных заболеваний, таких как наследственная слепота (Luxturna), некоторые виды лейкемии (CAR-T), врождённые болезни печени. Эти достижения, а также первое применение технологии прайм-редактирования для лечения хронической гранулематозной болезни подчёркивают потенциал генной терапии в лечении ранее неизлечимых заболеваний. Но скандалы напоминают: наука должна двигаться осторожно. В 2021 году ВОЗ выпустила первые глобальные рекомендации, «призванные помочь сделать редактирование генома человека инструментом общественного здравоохранения, уделяя особое внимание безопасности, эффективности и этике».
Как сказал нобелевский лауреат Дэвид Балтимор: «Немыслимое стало возможным. Мы близки к изменению наследственности человека, и нам нужно решить, как мы – как общество – будем использовать эту возможность».



