Российские учёные из Сеченовского университета первыми в мире создали экспериментальную систему генного редактирования, которая позволяет полностью уничтожать вирус гепатита В. Это важно, потому что существующие сегодня препараты только подавляют работу вируса, но не убивают его до конца.
Редактирование генома сегодня – одна из наиболее перспективных технологий, которая позволяет точечно вносить изменения в ДНК с помощью молекулярных инструментов и таким образом «править» природу – бороться с вирусами, устранять мутации, вызывающие тяжёлые заболевания, и повышать устойчивость растений. Однако по мере продвижения вперед встают и новые вопросы: где проходит граница допустимого и к каким последствиям может привести вмешательство в генетический код человека?
 Руководитель лаборатории генетических технологий в создании лекарственных средств Сеченовского Университета Дмитрий Костюшев. Фото: sechenov.ru
Руководитель лаборатории генетических технологий в создании лекарственных средств Сеченовского Университета Дмитрий Костюшев. Фото: sechenov.ruВзято у бактерий
Ключевым инструментом современной геномной инженерии стала технология CRISPR/Cas9, которую учёные позаимствовали у бактерий. Собственно, сам комплекс CRISPR/Cas9 и есть естественная иммунная система бактерий. Если у человека это сложный механизм, то у бактерии более простой, ведь она состоит из одной клетки с крошечным геномом. Когда вирус атакует клетку, то белок распознает его и уничтожает – разрезает вирусную ДНК, словно ножницами. Отсюда и название этой технологии – молекулярные ножницы.
В 2012 году вышла статья будущих Нобелевских лауреатов Эммануэль Шарпантье и Дженнифер Дудны, в которой авторы показали, как этот комплекс работает у бактерий и что его можно использовать в качестве редактирующего инструмента.
– А в 2013-м выяснилось, что, если внедрить эту систему – крошечную РНК с белком – в клетку млекопитающих (и, конкретно, в клетку человека), она тоже будет работать. Тоже найдёт уникальную последовательность нуклеотидов, и в этом месте фермент будет разрезать ДНК, – рассказывает Сергей Киселёв, заведующий лабораторией эпигенетики Института общей генетики имени Н.И. Вавилова. – Чтобы что-то исправить у человека, надо намешать (белки CAS) в пробирке и засунуть в клетку. Если всё правильно сделали, то в клетке человека произойдёт то, что мы хотим. А именно в определённое место генома будет внесён нужный разрыв ДНК. А уже дальше вступают в дело естественные происходящие в любой клетке универсальные для всего живого процессы под названием репарация – восстановление.
Восстановить разрыв клетка может разными способами: либо просто «сшивая» обрезанные куски, либо поставить своеобразную «заплатку» с правильным геном.
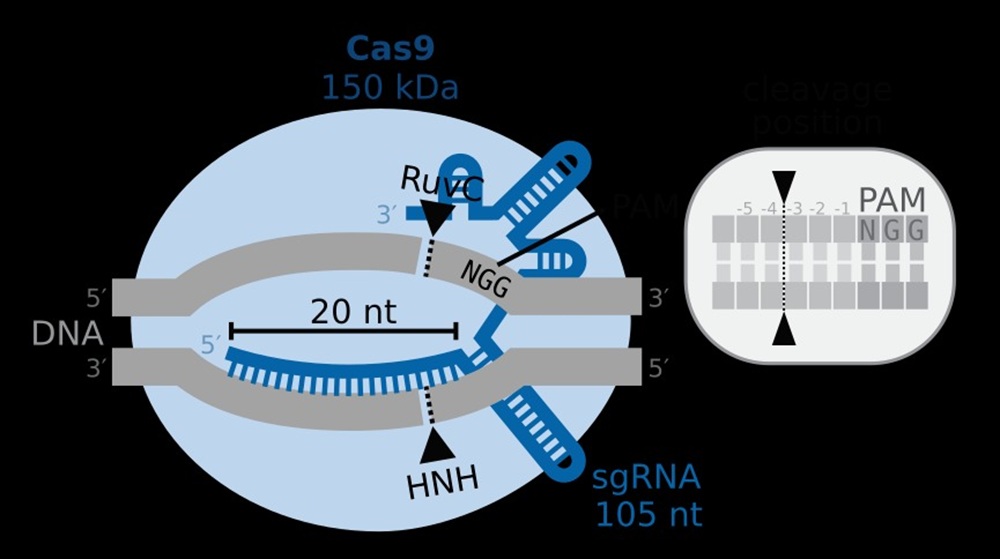 Схема CRISPR/Cas9. Фото: J.J.Froehlich / Wikipedia
Схема CRISPR/Cas9. Фото: J.J.Froehlich / WikipediaИсследования и достижения
Редактирование генома меняет сам подход к лечению – от симптоматической терапии к устранению первопричины болезни.
В Сеченовском университете проводили исследование более десяти лет. Учёные решали две большие проблемы: как доставить молекулярные ножницы в клетку и как научить CRISPR/Cas9 вырезать именно то, что нужно.
Проблема доставки – ключевая. CRISPR/Cas9 – довольно крупная молекулярная «машина», и уже поэтому её непросто доставить в клетку. Нужен способ, который сможет аккуратно её перевезти. При этом такая система должна работать быстро и исчезать без следа – не накапливаться в организме и не вызывать иммунную реакцию. Чаще всего для доставки используют вирусы: они хорошо проникают в клетки. Но есть проблема: иммунитет их запоминает. Поэтому учёные разработали крошечную капсулу из биодеградируемых наночастиц, которая невидима для охранной системы организма. Учёные обещают, что закончат исследование препарата в течение нескольких лет.
Это не единственная попытка приспособить молекулярные ножницы для борьбы с вирусами. Сейчас ведутся активные исследования препаратов против ВИЧ. ВИЧ, как и гепатит, – сложный для терапии вирус, поскольку обладает особенностью: благодаря своей специфически устроенной ДНК он может встраиваться в геном клетки человека и таким образом обманывать иммунную систему, становясь невидимой для неё.
Но учёные продолжают поиск этих решений. Так, специалистам из Амстердамского университета удалось с помощью системы CRISPR/Cas9 полностью устранить ВИЧ из клеточной культуры. А китайские учёные изучают использование методов редактирования генома для лечения хронического гепатита B. Их разработка направлена на полное уничтожение вирусной ДНК, сохраняющейся в клетках печени, что принципиально отличается от текущей терапии, лишь подавляющей размножение вируса.
 Электронная микрофотография вирусной геномной РНК ВИЧ. Фото: CDC / Dr. Edwin P. Ewing, Jr.
Электронная микрофотография вирусной геномной РНК ВИЧ. Фото: CDC / Dr. Edwin P. Ewing, Jr.В прошлом году в США благодаря этой технологии удалось вылечить ребёнка, у которого было не совместимое с жизнью генетическое заболевание. В результате печень малыша не выводила аммиак, который накапливался в организме и проникал в мозг. Для ребёнка разработали специальный генетический препарат, который вводили через капельницу. Таким образом было отредактировано большинство целевых клеток, и ребёнка смогли спасти.
Историческим шагом для медицины стало одобрение регуляторными органами в 2023–2024 годах в ряде стран первой генной терапии на основе CRISPR/Cas9 для лечения серповидноклеточной анемии. Это тяжёлое наследственное заболевание крови, при котором эритроциты приобретают форму серпа из-за аномального гемоглобина, разрушаются и закупоривают сосуды, приводя к сильным болям, поражению органов и риску инфекций. До последнего времени лечение было направлено на облегчение симптомов, а единственным излечивающим методом оставалась трансплантация стволовых клеток. Применение технологии CRISPR/Cas9 открыло новые возможности: молекулярные ножницы модифицируют геном таким образом, что вместо повреждённого взрослого гемоглобина начинает работать фетальный.
Мимо цели
В 2018 году в Китае родились первые генетически модифицированные дети – девочки-близнецы Лулу и Нана. Их будущие родители планировали процедуру ЭКО, так как мужчина был ВИЧ-положительным. Тогда-то в больнице они познакомились с учёным Хэ Цзянькуем из Южного научно-технологического университета, который предложил им участвовать в клиническом испытании. В процессе ЭКО учёный отредактировал геномы полученных эмбрионов при помощи метода CRISPR/Cas9 – модификации подвергся определённый ген, кодирующий белок, который ВИЧ использует для внедрения в клетку. Таким образом Хэ Цзянькуй рассчитывал искусственно создать мутацию в этом гене, которая встречается в единичных случаях и делает клетку устойчивой против ВИЧ.
 Ученый Хэ Цзянькуй. Фото: The He Lab / Wikipedia
Ученый Хэ Цзянькуй. Фото: The He Lab / WikipediaПо словам исследователя, дети родились здоровыми, но с редактированием генома прошло не всё гладко. У одной девочки вторая копия гена оказалась неактивна, а значит, защита не могла работать.
Неполная коррекция гена при попытке редактирования генома получила название «офф-таргет», то есть мимо цели. Такие непреднамеренные неспецифические изменения ДНК могут возникать, когда система ошибочно распознает и режет участки, похожие на целевую последовательность. К сожалению, в результате такого офф-таргета могут быть повреждены жизненно важные гены или активированы онкогены. Учёные из Колумбийского университета в Нью-Йорке выяснили, что количество побочных мутаций в результате использования редактирования генома намного больше, чем было принято считать. «Мы всё равно оптимистичны по поводу CRISPR. Будучи врачами, мы знаем, что любой новый вид терапии имеет потенциальные побочные эффекты. Но нам важно знать, каковы они», – утверждает один из исследователей Винит Махаджан.
В настоящее время учёные работают над усовершенствованием компонентов системы CRISPR/Cas9, чтобы сделать редактирование генома более эффективным и целенаправленным.
Спасение или угроза?
Сегодня геномное редактирование возможно только в соматических (неполовых) клетках – в этом случае изменения не передаются потомству. Редактирование же зародышевой линии остаётся открытым вопросом, поскольку в этом случае генетические изменения будут унаследованы будущими поколениями. Но и в целом в этой технологии остаётся ряд ключевых проблем, которые ещё предстоит решить. Например, непредсказуемый результат – ведь даже точные технологии могут вызывать побочные мутации. Есть риск появления «дизайнерских детей», когда вмешательство происходит не для лечения, а чтобы создать ребёнка определённой внешности и с определённым набором характеристик. Кроме того, дорогостоящие генные технологии могут усилить и социальное расслоение.
Международные организации призывают к введению глобальных этических стандартов и строгого контроля. По мнению многих экспертов, геномное редактирование способно спасти миллионы жизней, но при отсутствии чётких правил может создать новые угрозы.